Wann ist ein Molekül ein Dipol?
Wenn ein Molekül nach außen hin elektrisch neutral ist, dann ist die Rede von einem Dipolmolekül, welches kurz auch als Dipol bezeichnet werden kann. Alleine diese Tatsache reicht jedoch nicht aus, damit ein Molekül als Dipol bezeichnet werden kann. Es muss nicht nur nach außen hin elektrisch neutral sein, sondern die Elektronen müssen zudem asymmetrisch innerhalb dieses Moleküls verteilt sein.
Durch diese gegebenen Umstände bildet sich ein elektrischer Dipol, was daran liegt, dass dank der oben genannten Tatsachen vermieden wird, dass die positiven und negativen Ladungen und deren Schwerpunkte örtlich zusammenfallen. Diese Tatsache wiederum sorgt dafür, dass ein Molekül einen positiven und einen negativen Pol besitzt und somit eine Polarität hat und als Dipol bezeichnet werden kann.
Darum ist Ammoniak NH3 ein Dipol
Betrachtet man, unter der Berücksichtigung der oben genannten Tatsachen und Gegebenheiten, Ammoniak NH3 genau, dann wird man feststellen, dass es sich dabei um ein Dipol handelt. Dafür vergleicht man NH3 am besten mit CH4 und H2O. In der räumlichen Darstellung dieser Moleküle stellt man fest, dass alle drei dieser Moleküle jeweils über fünf Atome verfügen.
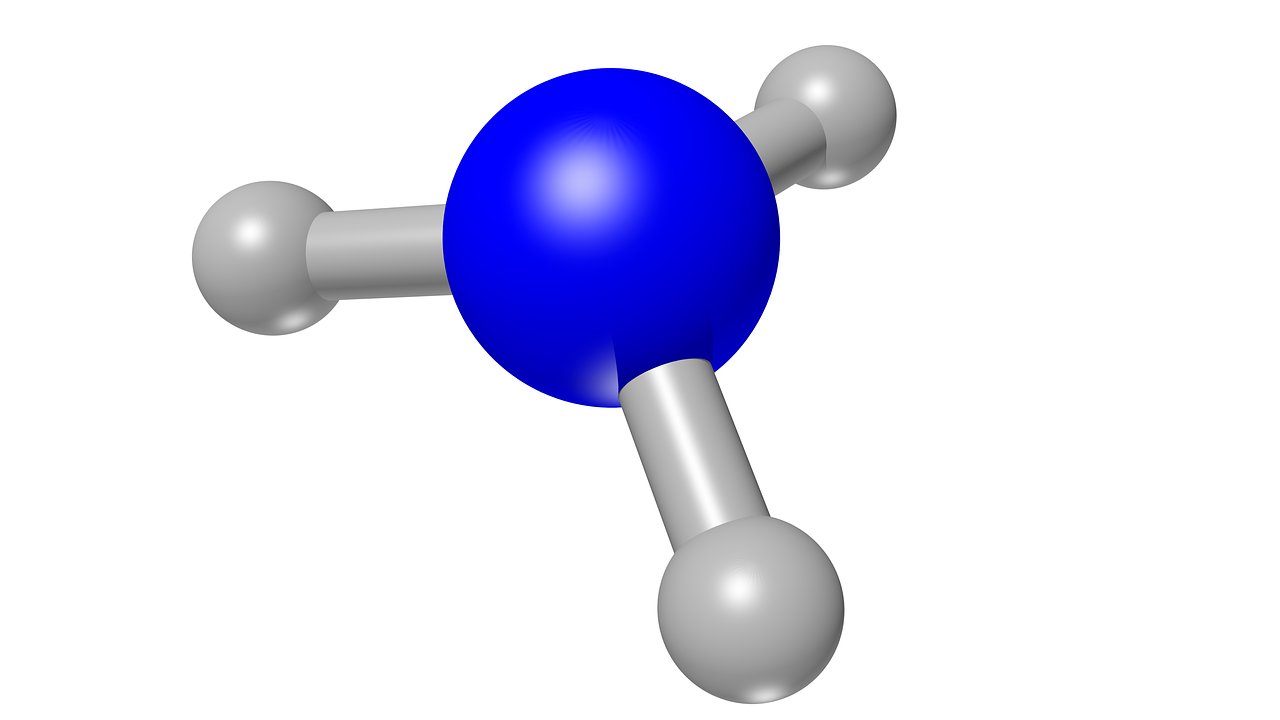
Ammoniak NH3
Wenn man sich anschließend ein Tetraeder in 3D vorstellt, kann man erkennen, dass es sich bei NH3 um ein Dipol handelt. Denn das Diplomolekül bezieht sich zum einen auf das Molekül NH3 an sich, gleichzeitig aber auch auf die räumliche Dimension.
Nun stellt man sich das Molekül CH4 so vor, dass C in dem Mittelpunkt eines Tetraeders platziert ist. Dabei sind die Atome H in den Ecken. Bei dem Molekül NH3 hingegen sitzt N in dem Mittelpunkt des Tetraeders. Die drei Atome H sind wiederum in den Ecken platziert.
Nun bleibt ein viertes Eck in dem Tetraeder übrig, welches mit einem sogenannten nichtbindenen Orbital besetzt wird.
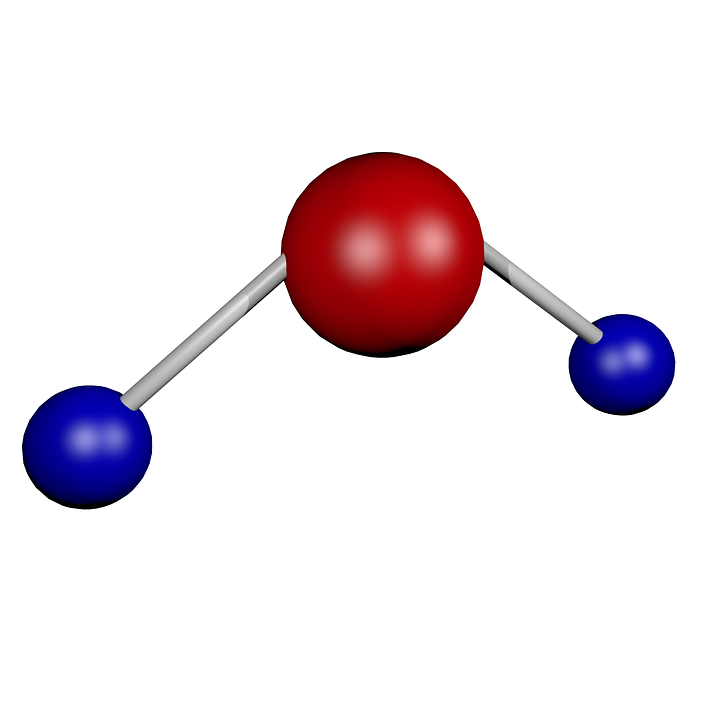 Betrachtet man das Molekül H2O, sitzt auch dort O in der Mitte , zwei H in zwei Ecken und in den anderen verbleibenden Ecken sitzen auch zwei nichtbindende Orbitale.
Betrachtet man das Molekül H2O, sitzt auch dort O in der Mitte , zwei H in zwei Ecken und in den anderen verbleibenden Ecken sitzen auch zwei nichtbindende Orbitale.
Wenn zwei unterschiedliche Atome sich binden, dann ist diese Bindung niemals gleich.
Die Bindung zweier gleicher Atome hingegen wird durch einen geraden Strich gekennzeichnet. Dies ist zum Beispiel unter anderem bei
- H2,
- O2 und
- N2 der Fall.
Bei zwei unterschiedlichen Atomen zieht das Atom, welches elektronegativer ist, die Bindung etwas mehr zu sich. Dabei gehört diese Bindung jedoch nicht diesem Molekül alleine. Durch diese Tatsache wird eine Bindung zwischen zwei ungleichen Atomen polar.
Durch diese Partialladungen, also Tendenzen, sind die Elektronen nicht mehr gleich verteilt, was dafür sorgt, dass sich der Dipolcharakter bildet.
Zwischen den beiden Seiten, der negativen und der positiven Seite, wird ein Vektor gebildet, welcher jeweils eine Richtung und auch einen Betrag hat. Letzterer ist immer die Differenz der Elektronegativitäten.
Erstere, also die Richtung Vektors, läuft dabei immer parallel zu der Bindung.
Wenn diese Dipolvektoren zusammenfallen, wie das bei wie CH4 der Fall ist, dann ist keine Rede von einem Dipol. Ein Dipol erhält man jedoch, wenn, wie bei NH3, der Vektor nicht durch einen anderen ausgelöscht wird. Es muss einen Vektor geben, welcher den gleichen Betrag, aber die entgegengesetzte Richtung hat, was bei Ammoniak NH3 der Fall ist.

Mein Name ist Anatoli Bauer und ich wohne im Norden an der Nordseeküste in Husum. Ich beschäftige mich leidenschaftlich gerne mit den Naturwissenschaften und interessiere mich vor allem für Physik und alles, was mit dem Weltraum und entfernten Planten zu tun hat.
Unsere Dienstleistungen:
-

Online Nachhilfe in Biologie 5-10. Klasse – 1 Std.
100,00 €inkl. 19 % MwSt.
-

Online Nachhilfe in Chemie 5-10. Klasse – 1 Std.
100,00 €inkl. 19 % MwSt.
-

Online Nachhilfe in Physik 5-10. Klasse – 1 Std.
100,00 €inkl. 19 % MwSt.








„ In der räumlichen Darstellung dieser Moleküle stellt man fest, dass alle drei dieser Moleküle jeweils über fünf Atome verfügen.“ Das ist falsch!! 😉